Buna göre zarar gören bölgenin yakınında hayatta kalan kalp hücreleri, daha önce sanıldığı gibi bağışıklık hücrelerinden değil, mekanik stresten dolayı iltihaplanıyor.
Bu kalp hücreleri parçalanıyor ve DNA sızdırıyor, bu da zararlı bir bağışıklık tepkisini tetikliyor. Bu çığır açıcı keşif, uzun süredir kabul gören varsayımları sarsarken, kalp krizinden sonra kalp yetmezliğini önlemeye yönelik yeni stratejilerin önünü açıyor: Bu da stres altındaki kalp hücrelerinin yatıştırılması ve belirli iltihaplanma sinyallerinin engellenmesiyle mümkün olabilir.
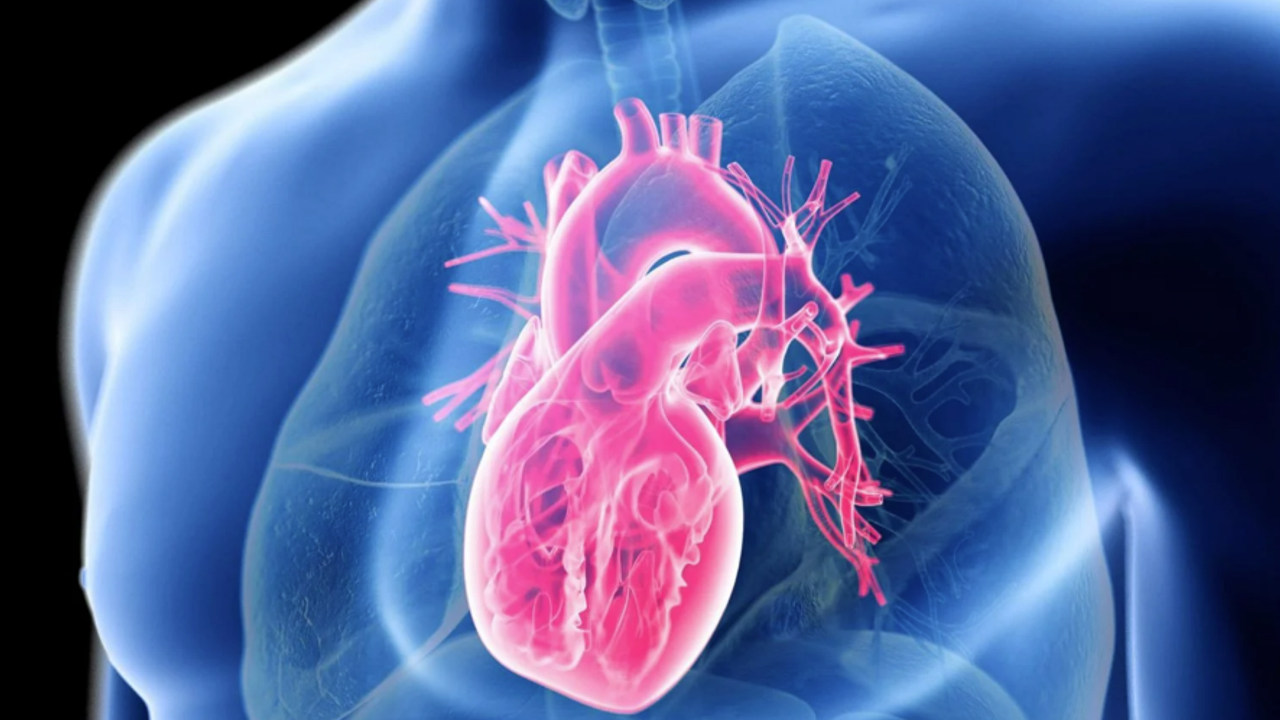
İskemik kalp hastalığı, dünya genelinde en yaygın ölüm nedenidir. Genellikle "miyokard enfarktüsü (MI)" olarak bilinen kalp kriziyle başlar; bu durum kalbin bir bölümüne kan akışının engellenmesiyle ortaya çıkar. Kan dolaşımının kesilmesi, kalp dokusunun ölmesine, yoğun iltihaplanmaya, kalp duvarında yapısal değişimlere ve nihayetinde kalp yetmezliğine yol açar.
İltihaplanma bu sürecin kilit bir unsuru olmasına rağmen, anti-inflamatuar (iltihap önleyici) ilaçlar kalp yetmezliğini önlemede etkili olmamıştır. Bu nedenle, kalp krizinden sonra rutin olarak kullanılmazlar. Araştırmacılar, bunun nedeni olarak en kritik iltihaplanma yolları ve hücresel hedeflerin hâlâ tanımlanamamış olmasını gösteriyor.
İltihaplanma Beklenmedik Bir Bölgede
Genellikle kalp krizinden sonra oluşan iltihaplanmanın, ölü hücre kalıntılarına tepki olarak kalbe hücum eden nötrofil ve makrofaj gibi bağışıklık hücrelerinden kaynaklandığı düşünülür. Ancak UC San Diego ekibi farklı bir şey buldu: Tip I interferon (IFN) sinyalleşmesiyle karakterize edilen güçlü bir inflamatuar tepki, doğrudan hasarlı bölgede değil, “sınır bölge” olarak bilinen ve kalp hücrelerinin hâlâ canlı olduğu çevre bölgede ortaya çıkıyordu.
Bu sınır bölge, kalp krizinden sonra hayatta kalan kas hücrelerinin stabil kalmaya ve bölünmeye çalıştığı, fakat araştırılması oldukça zor olan bir bölgedir. Araştırmacılar bu zorluğu, gen ekspresyonu desenlerine dayalı olarak hücreleri tanımlayan tek hücreli RNA dizileme (single-cell RNAseq) ve mekânsal transkriptomik yöntemleriyle aşmayı başardı.
Hangi hücre tipinin bu sınır bölge iltihabını başlattığını belirlemek için araştırma ekibi, farklı hücre tiplerinde IFN sinyalini başlatamayan genetik olarak değiştirilmiş fareler (koşullu gen silme - conditional knockout) kullanarak deneyler yaptı. Şaşırtıcı şekilde, kas hücreleri olan kardiyomiyositlerin IFN sinyalleşmesinde baskın rol oynadığı ortaya çıktı.
Araştırmaya göre, bu hücreler mekanik strese maruz kaldıklarında nükleer zarları sıkça yırtılıyor, bu da hücre içi DNA'nın dışarı sızmasına ve bağışıklık sisteminin bu DNA’yı tanıyıp tepki vermesine neden oluyor. Sonuç olarak, kalp duvarında zayıflama, incelme ve yırtılma riski artıyor. Araştırma ekibi, IFN yanıtı eksik olan farelerin MI sonrası daha iyi hayatta kalma oranları gösterdiğini daha önce de bildirmişti.
Çalışmanın kıdemli yazarı Dr. Kevin King, UC San Diego'da biyomühendislik ve kardiyoloji bölümlerinde görev yapıyor ve Sulpizio Kardiyovasküler Merkezi’nde kardiyolog olarak çalışıyor. Dr. King şöyle diyor:
“Hastanede her gün kalp krizi ve kalp yetmezliği olan hastalarla ilgileniyoruz. Kalp krizinden sonra kalp yetmezliğinin gelişmesini önleyebilecek yeni tedavi hedefleri, son derece önemli.”